| Ciencias de Joseleg
| Química | Química del equillibrio | Cinética
química | (Ejercicios) (Introducción)
(Generalidades)
(Factores
que afectan la velocidad de reacción) (Historia)
(Velocidad
de reacción) (Velocidades
de aparición y desaparición) (Relación
entre velocidades de aparición, desaparición y reacción) (Ley
de velocidad de reacción) (Reacciones
de primer orden) (Reacciones
de segundo orden) (Reacciones
de cero orden) (Vida
media) (Energía
de activación) (Mecanismo
de reacción) (Catalizadores)
(Referencias)
Una
ecuación equilibrada para una reacción química indica las sustancias presentes
al comienzo de la reacción y las presentes al final de la reacción. Sin
embargo, no proporciona información sobre los pasos detallados que ocurren a
nivel molecular a medida que los reactivos se convierten en productos. Los
pasos por los cuales ocurre una reacción se llama mecanismo de reacción “e
involucran fórmulas extrañas que normalmente no deberían ser correctas, de allí
que son transitorias e inestables”. En el nivel más sofisticado, un mecanismo
de reacción describe el orden en que los enlaces se rompen y forman y los
cambios en las posiciones relativas de los átomos en el curso de la reacción.
En
química, un mecanismo de reacción es la secuencia paso a paso de reacciones
elementales por las cuales ocurre un cambio químico general. Un mecanismo
químico es una conjetura teórica que trata de describir en detalle lo que
ocurre en cada etapa de una reacción química general. Los pasos detallados de
una reacción no son observables en la mayoría de los casos. El mecanismo
conjeturado se elige porque es termodinámicamente factible y tiene soporte experimental
en intermedios aislados u otras características cuantitativas y cualitativas de
la reacción. También describe cada intermedio reactivo, complejo activado y
estado de transición, y qué enlaces se rompen (y en qué orden), y qué enlaces
se forman (y en qué orden). Un mecanismo completo también debe explicar la
razón de los reactivos y catalizadores utilizados, la estereoquímica observada
en los reactivos y productos, todos los productos formados y la cantidad de
cada uno.
Reacciones
elementales
Hemos visto que las reacciones tienen lugar debido a colisiones entre las moléculas que reaccionan. Por ejemplo, las colisiones entre moléculas de metil isonitrilo CH3NC pueden proporcionar la energía para permitir que el CH3NC se reorganice en acetonitrilo:
Figura
14‑1. Mecanismo de reacción de la síntesis de acetonitrilo.
De
manera similar, la reacción de NO y O3 para formar NO2 y O2
parece ocurrir como resultado de una sola colisión que involucra moléculas de
NO y O3 adecuadamente orientadas y suficientemente energéticas: NO(g)+O3(g)→NO2(g)+O2(g),
ambas reacciones ocurren en un solo evento o paso y se llaman reacciones
elementales. El número de moléculas que participan como reactivos en una
reacción elemental define la molecularidad de la reacción. Si está involucrada
una sola molécula, la reacción es unimolecular. La reorganización del metil
isonitrilo es un proceso unimolecular. Las reacciones elementales que implican
la colisión de dos moléculas reactivas son bimoleculares. La reacción entre NO
y O3 es bimolecular. Las reacciones elementales que implican la
colisión simultánea de tres moléculas son termoleculares. Las reacciones termoleculares
son mucho menos probables que los procesos unimoleculares o bimoleculares y son
extremadamente raras. La posibilidad de que cuatro o más moléculas choquen
simultáneamente con cualquier regularidad es aún más remota; en consecuencia,
tales colisiones nunca se proponen como parte de un mecanismo de reacción. Por
lo tanto, casi todos los mecanismos de reacción contienen solo reacciones
elementales unimoleculares y bimoleculares.
Mecanismos multi-paso
El cambio neto representado
por una ecuación química equilibrada a menudo ocurre por un mecanismo de varios
pasos que consiste en una secuencia de reacciones elementales. Por ejemplo, por
debajo de 225 ° C, la reacción: NO2(g)+CO(g)→NO(g)+CO2(g)., Parece proceder en
dos reacciones elementales (o dos pasos elementales), cada uno de los cuales es
bimolecular. Primero, dos moléculas de NO2 chocan y un átomo de oxígeno se
transfiere de una a la otra. El NO3 resultante luego colisiona con una molécula
de CO y le transfiere un átomo de oxígeno. Como el NO3 no es un
reactivo ni un producto de la reacción, se forma en una reacción elemental y se
consume en la siguiente, se llama intermedio. Los mecanismos de múltiples pasos
involucran uno o más intermedios. Los intermedios no son lo mismo que los
estados de transición. Los intermedios pueden ser estables y, por lo tanto, a
veces pueden identificarse e incluso aislarse.
Los estados de transición, por otro lado, siempre son inherentemente
inestables y, como tales, nunca pueden aislarse. Sin embargo, el uso de
técnicas avanzadas "ultrarrápidas" a veces nos permite caracterizarlas.
Figura 14‑2. El perfil energético de una reacción, que muestra
estados de transición y un intermedio.
Ley de velocidad de reacción para reacciones elementales
En secciones anteriores, enfatizamos que las leyes de velocidad de reacción deben determinarse
experimentalmente; no pueden predecirse a partir de los
coeficientes de ecuaciones químicas equilibradas. Ahora estamos en condiciones
de entender por qué esto es así. Cada reacción se compone de una serie de uno o
más pasos elementales, y las leyes de velocidad y las velocidades relativas de
estos pasos dictan la ley de velocidad general para la reacción. De hecho, la
ley de velocidad para una reacción se puede determinar a partir de su mecanismo,
como veremos en breve, y se puede comparar con la ley de velocidad
experimental. Por lo tanto, nuestro próximo desafío en cinética es llegar a
mecanismos de reacción que conduzcan a leyes de velocidad consistentes con las
observadas experimentalmente. Comenzamos examinando las leyes de velocidad de
las reacciones elementales. Las reacciones elementales son significativas de
una manera muy importante: si una reacción es elemental, su ley de velocidad se
basa directamente en su molecularidad. Por ejemplo, considere la reacción
unimolecular (A → B).
A medida que aumenta el número de moléculas A, el número que reacciona en
un intervalo de tiempo dado aumenta proporcionalmente. Por lo tanto, la tasa de
un proceso unimolecular es de primer orden:
Para los pasos elementales bimoleculares ( A + B → C + D), la ley de
velocidad es de segundo orden, como en la reacción.
La ley de tasa de segundo orden se deriva directamente de la teoría de
colisión. Si duplicamos la concentración de A, el número de colisiones entre
las moléculas de A y B se duplica; asimismo, si duplicamos [B], el número de
colisiones entre A y B se duplica. Por lo tanto, la ley de tasas es de primer
orden tanto en [A] como [B] y en segundo orden en general. Las leyes de
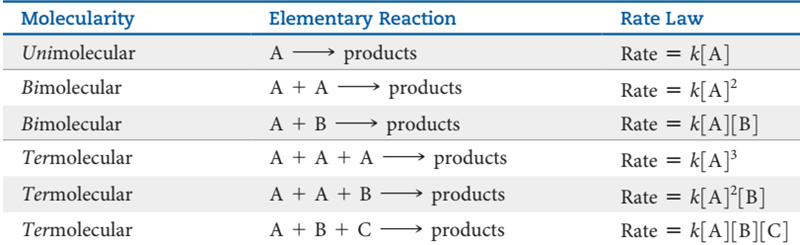
velocidad para todas las reacciones elementales factibles se dan en la tabla:
Tabla 14‑1. Reacciones elementales y sus
leyes de velocidad de reacción.
Observe
cómo cada ley de velocidad se sigue directamente de la molecularidad de la
reacción, en otras palabras, aunque la ley de velocidad general no usa los
números estequiométricos las leyes de velocidad para los mecanismos si lo hacen.
Es importante recordar, sin embargo, que no podemos decir simplemente
observando una ecuación química global equilibrada si la reacción involucra uno
o varios pasos elementales. De lo anterior se sigue que:
👉 En una reacción de mecanismo a un
paso, los órdenes de reacción son iguales a los números estequiométricos;
👉 si lo anterior no se cumple, significa
que el mecanismo de reacción involucrados o más pasos elementales.
El
problema ahora radica en que cada paso elemental al poseer su propia cinética
va a generar efectos distintivos en la ley de cinética general. A continuación,
analizaremos dos casos para reacciones cuyo mecanismo involucra dos pasos.
Adicionalmente es conveniente recordar que:
👉 los mecanismos termoleculares son
raros comparados con los monomoleculares y bimoleculares.
El
paso determinante de la velocidad para un mecanismo de varios pasos
La mayoría
de las reacciones ocurren por mecanismos que involucran dos o más reacciones
elementales. Cada paso del mecanismo tiene su propia constante de velocidad y
energía de activación.
Primer paso más lento
A menudo,
un paso es mucho más lento que los demás y la velocidad general de una reacción
no puede exceder la velocidad del paso elemental más lento. Debido a que el
paso lento limita la velocidad de reacción general, se le llama paso determinante de la velocidad.
En algunas
reacciones químicas la diferencia de velocidad de reacción entre los pasos
puede llegar a ser de varios órdenes de magnitud diferentes, por lo que la velocidad de reacción de la más lenta va a ser casi
igual a la velocidad de reacción general, asumiendo que las
velocidades de reacción de los siguientes pasos son insignificantes.
Química de Chang 10
✔ Ejemplo 13.10. Se cree que la descomposición en
fase gaseosa del óxido nitroso (N2O) ocurre a través de dos pasos
elementales. Experimentalmente se encuentra que la ley de velocidad es de r
= k[N2O]. (a) Escriba
la ecuación para la reacción global. (b) Identifique los intermedios. (c) ¿Qué
puede decir acerca de las tasas relativas de los pasos 1 y 2?
✔ Práctica
13.10. Se cree que la reacción entre NO2
y CO para producir NO y CO2 ocurre a través de dos pasos. La ley de
velocidad experimental es la velocidad r = k[NO2]2.
(a) Escriba la ecuación para la reacción global. (b) Identifique el intermedio.
(c) ¿Qué puede decir acerca de las tasas relativas de los pasos 1 y 2?
Brown13 química la ciencia central
✔ Muestra 14.12. Se ha propuesto que la conversión de ozono en O2 procede
mediante un mecanismo de dos pasos: O3(g) → O2(g) + O(g); O3(g) +
O(g) → 2 O2(g) (a) Describa la molecularidad de cada reacción
elemental en este mecanismo. (b) Escriba la ecuación para la reacción global.
(c) Identifique los productos intermedios.
✔ Práctica 14.12.1. Considere el siguiente mecanismo de reacción de dos pasos: A(g) + B(g) →
X(g) + Y(g); X(g) + C(g) → Y(g) + Z(g)
¿Cuál de las siguientes afirmaciones sobre este mecanismo es verdadera? (i)
Ambos pasos en este mecanismo son bimoleculares. (ii) La reacción global es
A(g) + B(g) + C(g) → Y(g) + Z(g). (iii) La sustancia X(g) es un intermediario
en este mecanismo. (a) Solo una de las afirmaciones es verdadera. (b) Las
afirmaciones (i) y (ii) son verdaderas. (c) Las afirmaciones (i) y (iii) son
verdaderas. (d) Las afirmaciones (ii) y (iii) son verdaderas. (e) Las tres
afirmaciones son verdaderas.
✔ Práctica 14.12.2. Para la reacción Mo(CO)6 + P(CH3)3 →
Mo(CO)5P(CH3)3 + CO, el mecanismo propuesto es
Mo(CO)6 → Mo(CO)5 + CO;
Mo(CO)5 + P(CH3)3 → Mo(CO)5P(CH3)3 (a) ¿El mecanismo propuesto es consistente
con la ecuación de la reacción total? (b) ¿Cuál es la molecularidad de cada
paso del mecanismo? (c) Identifique el(los) intermedio(s)
✔ Muestra 14.13. Si la siguiente reacción ocurre en una sola reacción elemental, prediga
su ley de velocidad: H2(g) + Br2(g) → 2 HBr(g)
✔ Práctica 14.13.1. Considere la siguiente reacción: 2 A + B → X + 2 Y. Se le dice que el
primer paso en el mecanismo de esta reacción tiene la siguiente ley de
velocidad: Velocidad = k[A][B]. ¿Cuál de los siguientes podría ser el primer
paso en el mecanismo de reacción (tenga en cuenta que la sustancia Z es un
intermedio)? (a) A + A → Y + Z (b)A → X + Z (c) A + A + B → X + Y + Y (d)B → X
+ Y (e) A + B → X + Z
✔ Práctica 14.13.2. Considere la siguiente reacción: 2
NO(g) + Br2(g) → 2NOBr(g). (a) Escriba la ley de velocidad para la
reacción, suponiendo que involucra una sola reacción elemental. (b) ¿Es
probable un mecanismo de un solo paso para esta reacción?
✔ Muestra 14.14. Se cree que la descomposición del óxido nitroso, N2O, ocurre mediante un
mecanismo de dos pasos: N2O(g) → N2(g) + O(g)
(lenta); N2O(g) + O(g) → N2(g)
+ O2(g) (rápida) (a) Escriba la ecuación para la reacción general.
(b) Escriba la ley de velocidad para la reacción global.
✔ Práctica 14.14.1. Consideremos una reacción hipotética 2 C + D → J + 2 K. Se le dice que
la velocidad de esta reacción es de segundo orden general y de segundo orden en
[C]. ¿Podría alguno de los siguientes ser un primer paso determinante de la
velocidad en un mecanismo de reacción que sea consistente con la ley de
velocidad observada para la reacción (tenga en cuenta que la sustancia Z es un
intermedio)? (a) C + C → K + Z (b) C → J + Z (c) C + D → J + Z (d) D → J + K
(e) Ninguno de estos es consistente con la ley de velocidad observada.
✔ Práctica 14.14.2. El ozono reacciona con el dióxido de nitrógeno para producir pentóxido
de dinitrógeno y oxígeno: O3(g) + 2 NO2(g) → N2O5(g)
+ O2(g) Se cree que la reacción ocurre en dos pasos: O3(g)
+ NO2(g) → NO3(g) + O2(g) NO3(g) +
NO2(g) → N2O5(g) La ley de velocidad
experimental es velocidad = k[O3][NO2] . ¿Qué puede decir
acerca de las velocidades relativas de los dos pasos del mecanismo?
Segundo paso más lento
En este
caso la rapidez promedio general parece no concordar, o no estar expresada en
términos del paso determinante, esto se debe a que el paso determinante está
expresado en términos de intermediarios, pero aun así sigue siendo un embudo de
paso. Lo que debe hacerse es expresar la sustancia intermedia en términos de
las concentraciones de la reacción rápida asumiendo que se ha alcanzado un
equilibrio. De esta manera para el mecanismo A ⇌ B, B → C para
la forma general A → C tendríamos que:
👉 Plantear la rapidez promedio para
las reacciones reversa y directa del paso 1.
👉 Despejar la
concentración de la o las sustancias intermediarias.
👉 Igualar en la
rapidez promedio del paso 2.
👉 Cancelar
términos.
Brown13 química la ciencia central
✔ ejemplo página 604. Experimentalmente se ha determinado que la rapidez promedio de una
reacción química es r k[NO]2[Br2], la cual se cree está
dada por un mecanismo de reacción de dos pasos, cuyo segundo paso es el
determinante NO + Br2 ⇌ NOBr2, NOBr2 + NO→ 2 NOBr. Demuestre que el
mecanismo dado es consistente con la ecuación medida experimentalmente.
✔ Muestra 14.15. Experimentalmente se ha determinado
que la rapidez promedio de una reacción química es r = k[NO]2[Br2],
la cual se cree está dada por un mecanismo de reacción de dos pasos, cuyo
segundo paso es el determinante NO(g) + NO(g) ⇌ N2O2(g), N2O2(g) + Br2(g)
→ 2 NOBr(g). Demuestre que el mecanismo dado es consistente con la ecuación
medida experimentalmente.
✔ Práctica 14.15.1. Considere la siguiente reacción hipotética: 2 P + Q → 2 R + S. Se
propone el siguiente mecanismo para esta reacción: P + P ⇌ T (rápida) Q + T → R + U (lenta) U → R + S (rápida) Sustancias T y U
son intermediarios inestables. ¿Qué ley de velocidad predice este mecanismo?
(a) Tasa = k[P]2 (b) Tasa = k[P][Q] (c) Tasa = k k[P]2[Q]
(d) Tasa = k[P][Q]2 (e) Tasa
= k[U]
✔ Práctica 14.15.2. El primer paso de un mecanismo que implica la reacción del bromo es Br2(g) ⇌ 2 Br(g) (rápido), ¿Cuál es la expresión que relaciona la concentración de Br(g) con la de Br2(g)?

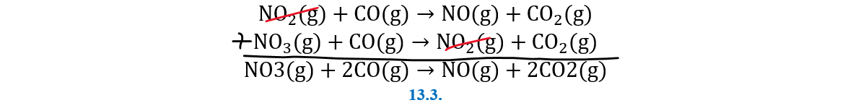





No hay comentarios:
Publicar un comentario