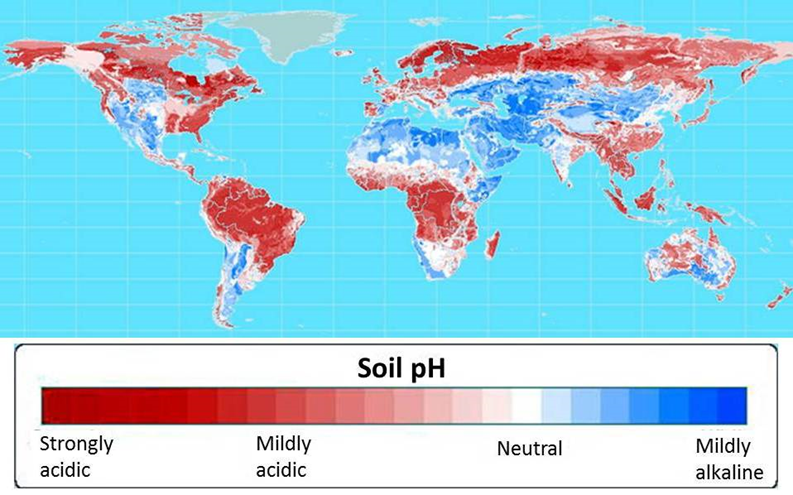
| Ciencias de Joseleg
| Química | Química del equilibrio | Teoría
ácido base | (Ejercicios)
(Generalidades)
(Teoría
de Arrhenius) (Teoría
de Brønsted-Lowry) (Constante
de disociación ácida Ka) (Introducción
a la teoría de Lewis) (Producto
iónico del agua Kw) (El
pH) (Reacciones
ácido-base) (Indicadores
de acidez) (Efecto
de la acidez en el suelo) (Referencias
bibliográficas)
Baeza-Baeza,
J. J., & García-Alvarez-Coque, M. C. (2014). Extent of Reaction Balances: A Convenient Tool
to Study Chemical Equilibria. World J. Chem. Educ, 2, 54–58.
Bishop, E. (2013). Indicators: international
series of monographs in analytical chemistry (Vol. 51). Elsevier.
Brady, N. C., & Weil, R. R. (2016). The
nature and properties of soils . Columbus, EUA: Pearson Education. Inc.[Links].
Brock, W. H. (2016). The History of
Chemistry: A Very Short Introduction. Oxford University Press.
Brown, T. L., LeMay, H. E. J., Bursten, B. E.,
Murphy, C. J., Woodward, P., & Stoltzfus, M. W. (2015). Chemistry the
Central Science.
Clark, R. B., Frid, C., & Attrill, M.
(1989). Marine pollution (Vol. 4). Clarendon Press Oxford.
Coleman, W. F. (2008). Molecular Models of
Indicators. ACS Publications.
Eamon, W. (1980). New light on Robert Boyle and
the discovery of colour indicators. Ambix, 27(3), 204–209.
Eliade, M., ET, &
Ledesma, M. P. (1974). Herreros y alquimistas. Alianza Madrid.
García-García, J. L.
(2020). El álgebra de la estequiometría. Educación química, 31(1),
138–150.
Garst, J. F. (1974). The extent of reaction as a unifying
basis for stoichiometry in elementary chemistry. Journal of Chemical
Education, 51(3), 194.
Goyer, R. A., Bachmann, J., Clarkson, T. W.,
Ferris Jr, B. G., Graham, J., Mushak, P., … Sharpe, W. (1985). Potential human
health effects of acid rain: report of a workshop. Environmental Health
Perspectives, 60, 355.
Gupta, N., Gaurav, S. S., & Kumar, A.
(2013). Molecular basis of aluminium toxicity in plants: a review. American Journal
of Plant Sciences, 4(12), 21.
Hansson, K., Olsson, B. A., Olsson, M.,
Johansson, U., & Kleja, D. B. (2011). Differences in soil properties in
adjacent stands of Scots pine, Norway spruce and silver birch in SW Sweden. Forest
Ecology and Management, 262(3), 522–530.
Haynes, R. J. (1982). Effects of liming on
phosphate availability in acid soils. Plant and soil, 68(3),
289–308.
Huang, P. M., Li, Y., & Sumner, M. E.
(2011). Handbook of soil sciences: resource management and environmental
impacts. CRC Press.
Kopittke, P. M., Menzies, N. W., Wang, P.,
& Blamey, F. P. C. (2016). Kinetics and nature of aluminium rhizotoxic
effects: a review. Journal of experimental botany, 67(15),
4451–4467.
Kumar, A., Patil, R. S., Dikshit, A. K., Islam,
S., & Kumar, R. (2016). Evaluation of control strategies for industrial air
pollution sources using American Meteorological Society/Environmental
Protection Agency Regulatory Model with simulated meteorology by Weather
Research and Forecasting Model. Journal of Cleaner Production, 116,
110–117.
Larrañaga, M. D., Lewis, R. J., & Lewis, R.
A. (2016). Highlights in the History of Chemistry. Hawley’s Condensed
Chemical Dictionary, Sixteenth Edition, 1462–1470.
Levere, T. H. (2001). Transforming matter: a
history of chemistry from alchemy to the buckyball. JHU Press.
Mancuso, A. (2010). The Effect of the
Accumulation of Heavy Metals in Soil on the Growth of Vegetation in the Long
Island Solar Farm. Brookhaven National Laboratory.
Newman, M. C. (2014). Fundamentals of ecotoxicology:
the science of pollution. CRC press.
Nørby, J. G. (2000). The origin and the meaning
of the little p in pH. Trends in biochemical sciences, 25(1),
36–37.
Pardue, H. L., Odeh, I. N., & Tesfai, T. M.
(2004). Unified approximations: A new approach for monoprotic weak acid-base
equilibria. Journal of chemical education, 81(9), 1367.
Rout, G., Samantaray, S., & Das, P. (2001).
Aluminium toxicity in plants: a review. Agronomie, 21(1),
3–21.
Rouwet, D., Hidalgo, S.,
Joseph, E. P., & González-Ilama, G. (2017). Fluid geochemistry and volcanic unrest:
dissolving the haze in time and space.
Sgambato, F., Prozzo, S.,
Sgambato, E., Sgambato, R., & Milano, L. (2012). The 100th anniversary of the invention of pH
(1909-2009)-Part II. Was it really necessary to replace the Henderson equation
with that of Henderson-Hasselbalch? Italian Journal of Medicine, 5(4),
215–226.
Shavrukov, Y., & Hirai, Y. (2015). Good and
bad protons: genetic aspects of acidity stress responses in plants. Journal
of experimental botany, 67(1), 15–30.
Slessarev, E. W., Lin, Y., Bingham, N. L.,
Johnson, J. E., Dai, Y., Schimel, J. P., & Chadwick, O. A. (2016). Water
balance creates a threshold in soil pH at the global scale. Nature, 540(7634),
567.
Sörensen, S. P. L. (1912). Über die Messung und
Bedeutung der Wasserstoffionen-konzentration bei biologischen Prozessen. Ergebnisse
der Physiologie, 12(1), 393–532.
Sparks, D. L. (2003). Environmental soil
chemistry. Elsevier.
Sumner, M. E., & Farina, M. P. W. (1986).
Phosphorus interactions with other nutrients and lime in field cropping
systems. En Advances in soil science (pp. 201–236). Springer.
Thomas, G. W. (1996). Soil pH and soil acidity.
Methods of Soil Analysis Part 3—Chemical Methods, (methodsofsoilan3),
475–490.
Timberlake, K. C. (2015). Chemistry An
Introduction to General, Organic, and Biological Chemistry (15a ed.). USA:
Pearson.
Truog, E. (1947). The liming of soils. The
yearbook of agriculture 1947: Science in farming, 566–576.
Van Breemen, N., Driscoll, C. T., & Mulder,
J. (1984). Acidic deposition and internal proton sources in acidification of
soils and waters. Nature, 307(5952), 599.
van Breemen, N., Mulder, J., & Driscoll, C.
T. (1983). Acidification and alkalinization of soils. Plant and soil, 75(3),
283–308.
Veron, J. E. N. (2008). Mass extinctions and
ocean acidification: biological constraints on geological dilemmas. Coral
Reefs, 27(3), 459–472.