| Ciencias de Joseleg
| Química | Química del equillibrio | Equilibrio
químico | (Ejercicios)
(Introducción)
(Historia)
(Generalidades)
(Actividad)
(Ley
de acción de masas) (Constante
de equilibrio Kc) (Equilibrio
de gases, inverso, variable y múltiple) (El
principio de Le Chatelier y el Qc) (Estequiometría
del equilibrio) (Referencias)
En una reacción química, el equilibrio químico es el estado en el que tanto los reactivos como los productos están presentes en concentraciones que no tienen más tendencia a cambiar con el tiempo, de modo que no hay cambios observables en las propiedades del sistema.
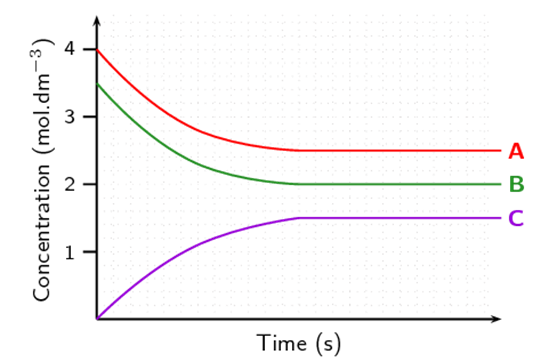
Figura 3‑1. Cambio de concentraciones de dos reactivos (A, B) y un producto
(C) en una reacción química que alcanza equilibrio.
Parámetros de NO equilibrio
Así pues, tendremos dos parámetros
diferentes en la reacción, no-equilibrio, donde las concentraciones de
reactivos disminuyen, mientras que las concentraciones de los productos
aumentan. Si tomamos los parámetros de concentración en cualquier momento en el
que no estén en equilibrio, los representaremos matemáticamente con la marca de
inicial (0 como superíndice o como subíndice ci0, ci,0,
[i]0) pero en este contexto se interpretará como no-equilibrio. Sin embargo, debido a que el
símbolo se concentración molar se repite constantemente, los químicos han
desarrollado una alternativa a ci y es la notación corchete
[i]. Esto debido a que el equilibrio y la ley de acción de masas dependen de
las masas activas o concentraciones, en lugar de las masas totales.
Parámetros en equilibrio
Una vez alcanzado el equilibrio, las
concentraciones se estabilizan en valores fijos que dependen de cierta
constante de proporcionalidad y las concentraciones iniciales. Estas
concentraciones en equilibrio las simbolizaremos sin marca (ci
= [i]), como si fueran valores finales, pero en este contexto se interpretarán
como parámetros en equilibro.
Tiempo de retraso
El tiempo de retraso indica la cantidad de
tiempo que tarda el sistema para alcanzar el equilibrio, en general entre mayor
sea el desequilibrio inicial más se tarda en alcanzar el equilibrio. Algunos
equilibrios son casi instantáneos como en las reacciones ácido-base, pero otros
son lentos, y aprovecharse de ese tiempo o acortarlo con catalizadores se emplea para optimizar las
reacciones a nivel industrial.
¿Cómo modelamos la ecuación química en
equilibrio?
Dado que en equilibrio están presentes dos
reacciones, una directa (→) y otra reversa (←), se emplea la doble flecha de un solo lado (⇋) para indicar que los productos de la reacción directa son a su
vez los reactivos de la reacción en reversa: a A(ac) + b B(l) ⇌ c C(g) + d D(s).
Tenga en cuenta que estar en equilibrio no
es lo mismo que tener las mismas cantidades de sustancia o concentraciones,
solo significa que alcanzarse el estado de equilibrio las concentraciones o
cantidades de sustancia de las especies químicas en la mezcla de reacción
aparentan estancarse como si la reacción se detuviera. Y esto es malo para la
industria, pues un reactor en equilibrio implica que parte de los reactivos
comprados jamás se convertirán en el producto que deseo vender, básicamente
esta primera sección de equilibrio indaga los modelos matemáticos y condiciones
físico-químicas que se emplean para evadir las limitaciones impuestas por el
equilibrio químico en un reactor industrial.
Cambios y
recuperación del equilibrio
Una vez establecido el equilibrio este
puede alterarse, pór ejemplo adicionando reactivos como se muestra en la
siguiente gráfica.
Figura 3‑2. Alteración del equilibrio por adición de reactivos. Aunque la
magnitud absoluta de nuevo equilibrio es diferente a la magnitud original, ésta
seguirá dependiendo de las más activas o concentraciones de los reactivos y
productos así como de las condiciones fisicoquímicas del entorno o sistema como
la presión y la temperatura.
Los cambios en los equilibrios dependen de
otros factores además de la concentración, pero eso lo veremos más adelante en
la siguiente lección.
Importancia biológica del equilibrio
Aunque el texto de química general clásico
se enfoca en las aplicaciones industriales, los biólogos se han percatado que
muchas reacciones biológicas clave se encuentran gobernadas por las leyes del
equilibrio químico. Por ejemplo la ecuación química general de la glucólisis: glucosa + 2
ADP+ 2 NAD ⇌ 2 ATP + 2 NADH:H + pirivato.
En la glucólisis tenemos una serie de pasos intermedios, varios de los cuales
son reacciones reversibles, por lo que, en sentido neto, la glucólisis es
gobernada por condicionamientos de reacciones reversibles, y uno de los más
graves es que si se acumulan los productos en la célula o el reactor, la
reacción total aparenta detenerse para todos los sentidos prácticos, sean
industriales o biológicos. Por ende, la célula debe consumir los productos
importantes como los portadores de energía (ATP y NADH:H) y deshacerse lo más
rápido y eficientemente posible de desechos como el piruvato, pues según las
leyes de la cinética y el equilibrio químico, si los productos se acumulan la
reacción se hace más lenta o se revierte hacia los reactivos, y para una ruta
metabólica eso implica que ya no se genera energía.
Este es solo ejemplo de muchos en los
cuales existen intermediaros metabólicos que son tóxicos debido a que, si se
acumulan, el metabolismo se detiene y la célula muere, muchas enfermedades
metabólicas son de hecho causadas por defectos genéticos en los mecanismos de
excreción o conversión de los intermediarios metabólicos tóxicos. Por ejemplo,
el piruvato antes mencionado es convertido a intermediarios menos tóxicos en
nuestras células dependiendo del metabolismo, el músculo blanco, por ejemplo,
que es el gran músculo voluminoso propio de los pesistas o velocistas es anaeróbico,
eso se basa en el hecho de que sus células procesan el piruvato sin oxígeno,
sacrificando el portador de energía NADH:H para producir ácido láctico, que es
menos tóxico y puede acumularse más, ser reenviado al hígado y allí regenerar
glucosa.
Sin embargo, el musculo rojo y otros tejidos importantes como las neuronas son aeróbicos, y emplean el complejo de piruvato deshidrogenasa (PDHC) que acelera la conversión del piruvato en otro intermediario que es usado por la mitocondria para activar la respiración aeróbica, la cual degrada completamente el piruvato a dióxido de carbono que sale por los pulmones (no por el sudor) y aún más energía.
La deficiencia de PDHC es un trastorno mitocondrial con una presentación clínica variable que va desde la acidosis láctica congénita mortal hasta una ataxia o neuropatía relativamente leve (pues los defectos enzimáticos se distribuyen en escalas graduales de tipo Darwiniano con extremos muy leves y mortales, y un promedio de rango de enfermedad). En bebés y niños con deficiencia de PDHC, las características más comunes son retraso en el desarrollo e hipotonía, así como microcefalia adquirida, pues como se mencionó anteriormente, el cerebro es aeróbico. Las convulsiones y la ataxia también son características frecuentes. Las manifestaciones menos comunes incluyen malformaciones congénitas del cerebro, en particular ventriculomegalia y agenesia del cuerpo calloso, o cambios degenerativos, incluida la enfermedad de Leigh. El dismorfismo facial se observa en una pequeña parte de los pacientes. La deficiencia de PDHC es una de las causas más comunes de acidosis láctica primaria en niños. Se cree que la gravedad de la progresión de la enfermedad está relacionada con la gravedad de la acidosis láctica y con el nivel de actividad enzimática residual.



No hay comentarios:
Publicar un comentario