| Ciencias de Joseleg | Química | Química del equilibrio | Teoría ácido base | (Ejercicios) (Generalidades) (Teoría de Arrhenius) (Teoría de Brønsted-Lowry) (Constante de disociación ácida Ka) (Introducción a la teoría de Lewis) (Producto iónico del agua Kw) (El pH) (Reacciones ácido-base) (Indicadores de acidez) (Efecto de la acidez en el suelo) (Referencias bibliográficas)
Las
reacciones típicas de ácidos y bases incluyen las reacciones de ácidos con
metales, bases y iones carbonato o bicarbonato. Por ejemplo, cuando se deja
caer una tableta antiácida en el agua, el ion bicarbonato y el ácido cítrico en
la tableta reaccionan para producir burbujas de dióxido de carbono, agua y sal.
Una sal es un compuesto iónico que no tiene H+ como catión o, OH-
como anión.
Desplazamiento a metales
Los ácidos reaccionan con ciertos metales para producir gas
de hidrógeno H2 y una sal. Los metales que reaccionan con los
ácidos incluyen potasio, sodio, calcio, magnesio, aluminio, zinc, hierro y
estaño. En reacciones que son reacciones de reemplazo único, el ion metálico
reemplaza al hidrógeno en el ácido.
|
|
Ataque a sales
Cuando se agrega un ácido a un carbonato o bicarbonato, los productos
son dióxido de carbono gas, agua y un compuesto iónico. El ácido reacciona con
CO32- o HCO3- para
producir ácido carbónico, H2CO3, que se descompone
rápidamente en CO2 y H2O.
Neutralizaciones
La neutralización es una reacción entre un ácido y una base
para producir agua y una sal. El H+ de un ácido que puede ser
fuerte o débil y el OH- de una base fuerte se combinan para
formar agua como un solo producto. La sal es el catión de la base y el anión
del ácido. Supongamos que necesitamos
encontrar la molaridad de una solución de HCl, que tiene una concentración
desconocida. Podemos hacer esto mediante un procedimiento de laboratorio
llamado titulación en el cual neutralizamos una muestra de ácido con una
cantidad conocida de base. En una valoración, colocamos un volumen medido del
ácido en un matraz y agregamos algunas gotas de un indicador como la
fenolftaleína. En una solución ácida, la fenolftaleína es incolora. Luego
llenamos una bureta con una solución de NaOH de molaridad conocida y agregamos
cuidadosamente solución de NaOH al ácido en el matraz.
En la titulación, neutralizamos el ácido agregando un
volumen de base que contiene un número correspondiente de moles de OH-.
Sabemos que la neutralización se ha producido cuando la fenolftaleína en la
solución cambia de incolora a rosada. Esto se llama punto final de
neutralización. A partir del volumen agregado y la molaridad de la solución de
NaOH, podemos calcular el número de moles de NaOH, los moles de ácido y luego
la concentración del ácido. La estequiometria de este proceso la trabajamos en
la unidad anterior sobre disoluciones y unidades de concentración.

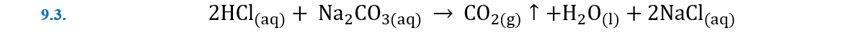



No hay comentarios:
Publicar un comentario