| Ciencias de Joseleg
| Química | Química del equillibrio | Cinética
química | (Ejercicios) (Introducción)
(Generalidades)
(Factores
que afectan la velocidad de reacción) (Historia)
(Velocidad
de reacción) (Velocidades
de aparición y desaparición) (Relación
entre velocidades de aparición, desaparición y reacción) (Ley
de velocidad de reacción) (Reacciones
de primer orden) (Reacciones
de segundo orden) (Reacciones
de cero orden) (Vida
media) (Energía
de activación) (Mecanismo
de reacción) (Catalizadores)
(Referencias)
Las velocidades de reacción de la mayoría de las reacciones químicas aumentan a medida que aumenta la temperatura. Por ejemplo, la masa aumenta más rápido a temperatura ambiente que cuando está refrigerada, y las plantas crecen más rápidamente en clima cálido que en frío. Podemos ver el efecto de la temperatura sobre la velocidad de reacción al observar una reacción de quimioluminiscencia (una que produce luz), como la de las barras de luz Cyalume® (Figura 13‑1.).
Figura 13‑1. La temperatura afecta la velocidad de la reacción de
quimioluminiscencia en barras de luz: la reacción de quimioluminiscencia ocurre
más rápidamente en agua caliente y se produce más luz.
¿Cómo se refleja este efecto de temperatura observado experimentalmente en
la ley de velocidad de reacción? La velocidad más rápida a una temperatura más
alta se debe a un aumento en la velocidad constante al aumentar la temperatura.
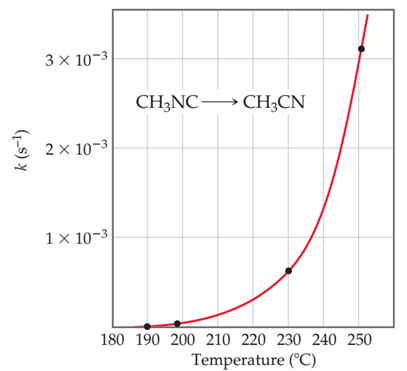
Por ejemplo, reconsideremos la reacción de primer orden que vimos en la Figura 12‑1, a saber, CH3NC
→CH3CN.
Figura 13‑2. Dependencia de la temperatura de la constante de
velocidad para la conversión de metilisonitrilo en acetonitrilo.
La Figura 13‑2 muestra la
constante de velocidad para esta reacción en función de la temperatura. La
velocidad constante y, por lo tanto, la velocidad de la reacción aumenta
rápidamente con la temperatura, aproximadamente el doble por cada aumento de 10
°C.
Modelo de colisiones
Las velocidades de reacción se ven afectadas tanto por las concentraciones
de reactivos como por la temperatura. El modelo de colisión, basado en la
teoría cinético-molecular (química de gases), explica ambos
efectos a nivel molecular. La idea central del modelo de colisión es que las
moléculas deben colisionar para reaccionar. Cuanto mayor es el número de
colisiones por segundo, mayor es la velocidad de reacción. A medida que aumenta
la concentración de reactivo, por lo tanto, aumenta el número de colisiones, lo
que conduce a un aumento en la velocidad de reacción. De acuerdo con la teoría
cinética molecular de los gases, el aumento de la temperatura aumenta las
velocidades moleculares. A medida que las moléculas se mueven más rápido,
chocan con más fuerza (con más energía) y con mayor frecuencia, aumentando las
velocidades de reacción.
Para que ocurra una reacción, sin embargo, se requiere más que simplemente
una colisión: debe ser el tipo correcto de colisión. Para la mayoría de las
reacciones, de hecho, solo una pequeña fracción de colisiones conduce a una
reacción. Por ejemplo, en una mezcla de H2 e I2 a
temperaturas y presiones normales, cada molécula sufre aproximadamente 1010
colisiones por segundo. Si cada colisión entre H2 e I2
resultara en la formación de HI, la reacción terminaría en mucho menos de un
segundo. En cambio, a temperatura ambiente, la reacción avanza muy lentamente
porque solo una de cada 1013 colisiones produce una reacción. ¿Qué
impide que la reacción ocurra más rápidamente?
Orientación de la molécula
En la mayoría de las reacciones, las colisiones entre moléculas provocan
una reacción química solo si las moléculas están orientadas de cierta manera
cuando colisionan.
Figura 13‑3. Las colisiones moleculares pueden o no conducir a una
reacción química entre Cl y NOCl.
Las orientaciones relativas de las moléculas durante la colisión determinan
si los átomos están posicionados adecuadamente para formar nuevos enlaces. Por
ejemplo, considere la reacción Cl + NOCl→ NO + Cl2., que tiene lugar
si la colisión une a los átomos de Cl para formar Cl2, como se
muestra en el panel superior de la Figura 13‑3. En contraste, en
la colisión que se muestra en el panel inferior, los dos átomos de Cl no chocan
directamente entre sí, y no se forman productos.
Energía de activación
La orientación molecular no es el único factor que influye en si una
colisión molecular producirá una reacción. En 1888, el químico sueco Svante
Arrhenius sugirió que las moléculas deben poseer una cierta cantidad mínima de
energía para reaccionar. Según el modelo de colisión, esta energía proviene de
las energías cinéticas de las moléculas en colisión. Tras la colisión, la
energía cinética de las moléculas se puede utilizar para estirar, doblar y
finalmente romper enlaces, lo que lleva a reacciones químicas. Es decir, la
energía cinética se usa para cambiar la energía potencial de la molécula. Si
las moléculas se mueven muy lentamente, en otras palabras, con muy poca energía
cinética, simplemente rebotan entre sí sin cambiar. La energía mínima requerida
para iniciar una reacción química se llama energía de activación, Ea,
y su valor varía de una reacción a otra.
Figura 13‑4. Se necesita energía para superar una barrera entre los
estados inicial y final.
La situación durante las reacciones es análoga a la que se muestra en la Figura 13‑4. El golfista
golpea la pelota para que se mueva sobre la colina en dirección a la copa. La
colina es una barrera entre la pelota y la copa. Para alcanzar la copa, el
jugador debe impartir suficiente energía cinética con el putter para
mover la pelota hacia la parte superior de la barrera. Si no imparte suficiente
energía, la pelota rodará hasta la mitad de la colina y luego regresará hacia
él. Del mismo modo, las moléculas requieren una cierta energía mínima para
romper los enlaces existentes durante una reacción química. Podemos pensar en
esta energía mínima como una barrera energética. En el reordenamiento de metil
isonitrilo a acetonitrilo, por ejemplo, podríamos imaginar la reacción pasando
a través de un estado intermedio en el que la porción N
La Figura 13‑5 muestra que se
debe suministrar energía para estirar el enlace entre el grupo H3C y
el grupo N ‚C para permitir que el grupo N
Figura 13‑5. Perfil energético para la conversión de metil
isonitrilo H3CNC en su isómero acetonitrilo H3CCN.
Por lo tanto, la barrera para la formación de acetonitrilo representa la
energía necesaria para forzar a la molécula a pasar por un estado intermedio
relativamente inestable, análogo a forzar la bola en la Figura 13‑4 sobre la colina.
La diferencia entre la energía de la molécula inicial y la energía más alta a
lo largo de la vía de reacción es la energía de activación, Ea.
La molécula que tiene la disposición de los átomos que se muestra en la parte
superior de la barrera se denomina complejo activado o estado de transición.
La conversión de H3C
cuanto menor es el valor de Ea,
más rápida es la reacción.
Tenga en cuenta que la reacción inversa es endotérmica. La energía de
activación para la reacción inversa es igual a la energía que debe superarse si
se acerca a la barrera desde la derecha: ∆E+Ea. Por lo
tanto, alcanzar el complejo activado para la reacción inversa requiere más
energía que para la reacción directa; para esta reacción, hay una barrera más
grande que vencer de derecha a izquierda que de izquierda a derecha.
Brown13 química la ciencia central
✔ muestra 14.10. Ordenar las reacciones modeladas con los
siguientes perfiles de energía de activación, desde la mas lenta a la mas
rápida.
Cualquier molécula particular de metil isonitrilo adquiere energía
suficiente para superar la barrera de energía a través de colisiones con otras
moléculas. Recordemos de la teoría cinética-molecular de los gases que, en
cualquier instante, las moléculas de gas se distribuyen en energía en un amplio
rango. La Figura 13‑6 muestra la
distribución de energías cinéticas para dos temperaturas, comparándolas con la
energía mínima necesaria para la reacción, Ea. A la
temperatura más alta, una fracción mucho mayor de las moléculas tiene una
energía cinética mayor que Ea, lo que conduce a una mayor
velocidad de reacción.
Figura 13‑6. El efecto de la temperatura sobre la distribución de las energías cinéticas de las moléculas en una muestra.
Para una colección de moléculas en la fase gaseosa, la fracción de
moléculas que tienen energía cinética igual o mayor que
En esta ecuación, R es la constante de los gases ideales (8.14 J/mol-K) y T es la temperatura absoluta. Para tener una idea de la magnitud de f, supongamos que Ea es 100 kJ/mol, un valor típico de muchas reacciones, y que T es 300 K. El valor calculado de f es 3.9×10-18, un número extremadamente pequeño. A 320 K, f= 4.7×10-17. Por lo tanto, solo un aumento de 20° en la temperatura produce un aumento de más de diez veces en la fracción de moléculas que poseen al menos 100 kJ/mol de energía.
La ecuación de Arrhenius
Arrhenius señaló que, para la mayoría de las reacciones, el aumento de la
velocidad con el aumento de la temperatura no es lineal (Figura 13‑2). Encontró que la
mayoría de los datos de velocidad de reacción obedecían a una ecuación basada
en:
👉 la fracción de moléculas que poseen energía Ea
o mayor,
👉 el número de colisiones por segundo, y
👉 la fracción de colisiones que tienen la orientación
apropiada. Estos tres factores se incorporan a la ecuación de Arrhenius:
El factor de frecuencia, A, es constante, o casi, a medida que varía
la temperatura. Este factor está relacionado con la frecuencia de las
colisiones y la probabilidad de que las colisiones estén orientadas
favorablemente para la reacción, debido a que la frecuencia de colisión aumenta
con la temperatura, A también tiene cierta dependencia de la
temperatura, pero esta dependencia es mucho menor que el término exponencial.
Por lo tanto, A se considera aproximadamente constante. A medida que aumenta la magnitud de Ea,k
disminuye porque la fracción de moléculas que poseen la energía requerida es
menor. Por lo tanto, a valores fijos de T y A, las velocidades de reacción disminuyen a medida que Ea
aumenta.
Usando la ecuación de
Arrhenius
🟦 DEMOSTRACIÓN. Modificar la ecuación de Arrhenius de
energía de activación para hallar: su forma lineal con logaritmos naturales, su
primer forma dinámica que permite calcular la energía de activación a partir de
una serie de datos de k vs T, y su segunda forma dinámica que permite calcular
k en términos de k0 y la energía de activación.
Opción gráfica
La
ecuación 13.5 muestra una opción gráfica para calcular la energía de activación.
Una gráfica de ln k versus 1/T
es una línea con una pendiente igual a –Ea/R y una
intersección en (y) igual a ln A. Por lo tanto, la energía de
activación se puede determinar midiendo k en una serie de temperaturas,
graficando ln k versus 1/T,
y calculando Ea a partir de la pendiente de la línea
resultante. Adicionalmente, en la opción gráfica vamos a tener dos subopciones
para resolver esto:
👉 Opción manual: deberemos
elegir: de la línea recta de manera arbitraria y calcular la pendiente
manualmente. esta opción tiene el problema de que, si los datos no apoyan una
línea recta perfecta, podremos calcular una energía de activación errónea, si
elegimos precisamente aquellos puntos que más se desvían de la línea recta. De
allí que para esta estrategia usted debe
analizar la gráfica y escoger los puntos que más se aproximen a la recta.
👉 Opción automática:
básicamente se trata de usar Excel, mediante los comandos insertar → Gráficos →
Dispersión → Dispersión con líneas suavizadas y marcadores → seleccionar la
recta en la gráfica → clic derecho → insertar línea de tendencia → lineal y
activar los comandos de ecuación del gráfico y valor de Rcuadrado. Al
graficar en Excel tenga cuidado de colocar primero la columna para el eje (x),
y luego la columna para el eje (y) en la tabla de datos antes que insertar una
gráfica de dispersión.
Opción analítica
La ecuación
13.4 nos muestra una opción analítica para calcular la energía de activación.
Debido a que podemos usar una variedad de parejas de datos, lo aconsejable es
calcular para las parejas adyacentes presentes y luego calcular el promedio
aritmético.
El valor de la constante
de los gases ideales
Recuerde que la
constante de gases ideales deberá expresarse en unidades de energía: 8.314 J /mol-K. Si lo que desea
es expresar directo en kilojulios debe usar 8.314 x 10-3 kJ /mol-K.
Cual opción es más
conveniente
Aunque la
teoría nos dice que la gráfica ln k vs 1/T debe ser una línea
recta, en la práctica los datos pueden no tener una relación de línea recta
simplemente debido a errores de muestreo, errores experimentales entre otros,
por lo que el método gráfico establecido por el libro de texto como la química
de Chang presenta un problema, elegir arbitrariamente las coordenadas para
dibujar la línea recta nos puede llevar a generar valores de energía de
activación diferentes aún dentro de la misma serie de datos, incluso los
valores que obtengamos como resultado de una regresión lineal o del promedio de
las energías de activación para cada pareja posible en la serie de datos puede
llevarnos a resultados que no son exactamente iguales. La pregunta es ¿cuándo
esperar que los valores por las dos rutas sean diferentes? y la respuesta
radica en el valor R2 de la regresión lineal que nos da Excel:
👉 para un valor de R2
igual a 1 significa que la regresión lineal se ajusta perfectamente a un modelo
de línea recta, y en consecuencia es de esperarse que la energía de activación
calculada gráficamente y analíticamente sean iguales.
👉 si el valor de R2 de la
regresión lineal en Excel es menor que uno, deberemos esperar que las energías
de activación calculadas por la ruta gráfica y por la ruta analítica tengan sus
diferencias. las diferencias aumentarán a medida que el valor de R2
se haga más diferente de 1.
Química de Chang10
✔ Ejemplo 13.8. Las constantes de velocidad para la descomposición del acetaldehído CH3CHO(g)
→ CH4(g) + CO(g) se midieron a cinco temperaturas diferentes. Los
datos se muestran en la tabla. Grafique ln k versus 1/T y determine la energía
de activación (en kJ/mol) para la reacción. Tenga en cuenta que la reacción es
de orden "3/2" en CH3CHO, por lo que k tiene las unidades
de 1/M1/2-s.
✔ Práctica 13.8. La
constante de velocidad de segundo orden para la descomposición del óxido
nitroso (N2O) en una molécula de nitrógeno y un átomo de oxígeno se
ha medido a diferentes temperaturas, y esta dada en la tabla de datos adjunta.
Determine gráficamente la energía de activación de la reacción.
✔ Ejemplo 13.9. La constante de velocidad de una reacción de primer orden es 3.46 × 10-2
s-1 a 298 K. ¿Cuál es la constante de velocidad a 350 K si la
energía de activación de la reacción es de 50.2 kJ/mol?
✔ Práctica 13.9. La constante de velocidad de primer orden para la reacción de cloruro de
metilo (CH3Cl) con agua para producir metanol (CH3OH) y
ácido clorhídrico (HCl) es 3.32 x 10-10 s-1 a 25°C.
Calcule la constante de velocidad a 40 °C si la energía de activación es de 116
kJ/mol.
Brown13 química la ciencia central
✔ muestra 14.11a. La siguiente tabla muestra las
constantes de velocidad para el reordenamiento del metilisonitrilo a varias
temperaturas: A partir de estos datos, calcule la energía de activación para la
reacción.
✔ muestra 14.11b. La siguiente tabla muestra las
constantes de velocidad para el reordenamiento del metilisonitrilo a varias
temperaturas: ¿Cuál es el valor de la
constante de velocidad a 430.0 K?
✔ Práctica 14.11.1. La siguiente tabla muestra las
constantes de velocidad para el reordenamiento del metilisonitrilo a varias
temperaturas. Tenga en cuenta que la energía de activación fue de 1.60 x 102
kJ/mol. ¿cuál de las siguientes es la constante de velocidad para el
reordenamiento del metilisonitrilo a 320 °C? (a) 8.1 x 10-15 s-1
(b) 2.2 x 10-13 s-1 (c) 2.7 x 10-9 s-1
(d) 2.3 x 10-1 s-1 (e) 9.2 x 103 s-1.
✔ Práctica 14.11.2. La siguiente tabla muestra las constantes de velocidad para el reordenamiento del metilisonitrilo a varias temperaturas. Tenga en cuenta que la energía de activación fue de 1.60 x 102 kJ/mol. Con una cifra significativa, ¿cuál es el valor del factor de frecuencia A?











No hay comentarios:
Publicar un comentario