| Ciencias de Joseleg
| Química | Química del equilibrio | Teoría
ácido base | (Ejercicios)
(Generalidades)
(Teoría
de Arrhenius) (Teoría
de Brønsted-Lowry) (Constante
de disociación ácida Ka) (Introducción
a la teoría de Lewis) (Producto
iónico del agua Kw) (El
pH) (Reacciones
ácido-base) (Indicadores
de acidez) (Efecto
de la acidez en el suelo) (Referencias
bibliográficas)
En el medio ambiente, la acidez medida como pH, de la lluvia, el agua y el suelo pueden tener efectos significativos. Cuando la lluvia se vuelve demasiado ácida (YouTube), puede disolver las estatuas de mármol y acelerar la corrosión de los metales. En lagos y estanques, la acidez del agua puede afectar la capacidad de las plantas y los peces para sobrevivir. La acidez del suelo alrededor de las plantas afecta su crecimiento. Si el pH del suelo es demasiado ácido o demasiado básico, las raíces de la planta no pueden absorber algunos nutrientes. La mayoría de las plantas prosperan en el suelo con un pH casi neutro, aunque ciertas plantas como las orquídeas, las camelias y los arándanos requieren un suelo más ácido. Los cambios en el pH de los fluidos corporales pueden afectar severamente las actividades biológicas dentro de las células. Las soluciones reguladoras de pH, también conocidas como tampones o buffer, están presentes para evitar grandes fluctuaciones en el pH (Brown et al., 2015).
Tabla 11‑1. Tipos de suelo por acidez medida en pH.
El impacto de los ácidos y las bases depende no solo del tipo de ácido o base, sino también de cuánto está presente. El tiempo requerido para que un objeto metálico sumergido en el agua se corroa, la capacidad de un medio acuático para sustentar la vida de los peces y las plantas, el destino de los contaminantes arrastrados por la lluvia e incluso las tasas de reacciones que mantienen nuestras vidas críticamente Depende de la acidez o basicidad de las soluciones. Por lo tanto, exploraremos en este capítulo cómo medimos la acidez y cómo las reacciones químicas de ácidos y bases dependen de sus concentraciones y de su estado de equilibrio.
El pH del suelo es una medida de la acidez o basicidad (alcalinidad) de un suelo (YouTube, acidez en los suelos cafeteros). En suelos, se mide en una mezcla de tierra mezclada con agua (o una solución de sal, como CaCl 0,01 M), y normalmente oscila entre 3 y 10, siendo 7 neutral. Los suelos ácidos tienen un pH inferior a 7 y los suelos alcalinos tienen un pH superior a 7. Los suelos ultraácidos (pH <3.5) y los suelos muy fuertemente alcalinos (pH > 9) son raros (Slessarev et al., 2016; Thomas, 1996). El pH del suelo se considera una variable maestra en los suelos, ya que afecta a muchos procesos químicos. Afecta específicamente la disponibilidad de nutrientes de las plantas al controlar las formas químicas de los diferentes nutrientes e influir en las reacciones químicas que experimentan. El rango óptimo de pH para la mayoría de las plantas está entre 5,5 y 7,5; (Slessarev et al., 2016; Thomas, 1996) sin embargo, muchas plantas se han adaptado para prosperar a valores de pH fuera de este rango.
El pH de un suelo natural depende de la composición mineral del material original del suelo y de las reacciones a la intemperie sufridas por ese material original. En ambientes cálidos y húmedos, la acidificación del suelo ocurre con el tiempo ya que los productos de la intemperie son lixiviados por el agua que se mueve lateralmente o hacia abajo a través del suelo. En climas secos, sin embargo, la meteorización y la lixiviación del suelo son menos intensas y el pH del suelo suele ser neutro o alcalino (Nico van Breemen, Mulder, & Driscoll, 1983).
Procesos que contribuyen a la acidificación de los suelos
Muchos procesos contribuyen a la acidificación del suelo, estos incluyen (Sparks, 2003; N Van Breemen, Driscoll, & Mulder, 1984):
Precipitación
Los suelos ácidos se encuentran con mayor frecuencia en áreas de alta precipitación. El agua de lluvia tiene un pH ligeramente ácido (generalmente alrededor de 5,7) debido a una reacción con CO2 en la atmósfera que forma el ácido carbónico. Cuando esta agua fluye a través del suelo, da como resultado la filtración de cationes básicos del suelo como bicarbonatos; esto aumenta el porcentaje de Al3+ y H+ relativo a otros cationes.
Metabolismo celular
La respiración radicular y la descomposición de la materia orgánica por microorganismos libera CO2 que aumenta la concentración de ácido carbónico (H2CO3) y lixiviación posterior.
Crecimiento de las plantas
Las plantas absorben nutrientes en forma de iones (por ejemplo, NO3-, NH4+, Ca2+, H2PO4-), y a menudo acaparan más cationes “positivos” que aniones “negativos”. Sin embargo, las plantas deben mantener una carga neutral en sus raíces. Para compensar la carga positiva adicional, emiten iones H+ desde la raíz. Algunas plantas también exudan ácidos orgánicos en el suelo para acidificar la zona alrededor de sus raíces para ayudar a solubilizar los nutrientes metálicos que son insolubles a pH neutro, como el hierro (Fe) e impedir el crecimiento de bacterias patógenas.
Fertilizantes
Uso de fertilizantes con base de amonio (NH4+), los cuales reaccionan en el suelo mediante el proceso de nitrificación para formar nitrato (NO3-), y en el proceso liberan iones H+.
Lluvia ácida
La quema de combustibles fósiles libera óxidos de azufre y nitrógeno a la atmósfera. Estos reaccionan con el agua en la atmósfera para formar ácido sulfúrico y nítrico en la lluvia.
Degradación oxidativa
La oxidación de algunos minerales primarios, especialmente sulfuros y aquellos que contienen ion ferroso Fe2+, generan acidez. Este proceso a menudo se acelera por la actividad humana.
Desechos de minas de oro y desecación de humedales
condiciones muy ácidas pueden formarse en los suelos cerca de algunos despojos de la mina debido a la oxidación de la pirita. Los suelos de sulfato ácido formados naturalmente en ambientes costeros y de estuarios saturados de agua pueden volverse altamente ácidos cuando se drenan o se excavan.
Procesos que contribuyen a la alcalinización de los suelos
Así mismo, los suelos pueden volverse alcalinos por varias razones, dentro de las cuales destacan (Sparks, 2003; N Van Breemen et al., 1984):
Meteorización de minerales
Meteorización de silicatos, aluminosilicatos y minerales de carbonato que contienen Na+, Ca2+, Mg2+ y K+. Adición de silicato, aluminosilicato y minerales de carbonato a los suelos; esto puede suceder por la deposición de material erosionado en otra parte por el viento o el agua, o por la mezcla del suelo con material menos meteorizado (como la adición de piedra caliza a suelos ácidos).
Aguas duras
Adición de agua que contiene bicarbonatos disueltos (como ocurre cuando se riega con aguas de alto contenido de bicarbonato).
La acumulación de alcalinidad en un suelo (como carbonatos y bicarbonatos de Na, K, Ca y Mg) ocurre cuando no hay suficiente agua fluyendo a través de los suelos para lixiviar las sales solubles. Esto puede deberse a condiciones áridas o a un drenaje interno del suelo pobre; En estas situaciones, la mayor parte del agua que ingresa al suelo es transpirada (absorbida por las plantas) o se evapora, en lugar de fluir a través del suelo (Sparks, 2003; N Van Breemen et al., 1984). El pH del suelo generalmente aumenta cuando la alcalinidad total aumenta, pero el resto de los cationes agregados también tiene un efecto marcado en el pH del suelo. Por ejemplo, aumentar la cantidad de sodio en un suelo alcalino tiende a inducir la disolución del carbonato de calcio, lo que aumenta el pH. Los suelos calcáreos pueden variar en pH de 7,0 a 9,5, dependiendo del grado en que Ca2+ o Na+.
Suelos ácidos
Las plantas cultivadas en suelos ácidos pueden experimentar una variedad de tensiones que incluyen toxicidad de aluminio (Al), hidrógeno (H) y / o manganeso (Mn), así como deficiencias de nutrientes de calcio (Ca) y magnesio (Mg) (Brady & Weil, 2016). La toxicidad del aluminio es el problema más extendido en los suelos ácidos. El aluminio está presente en todos los suelos, pero el Al3+ disuelto es tóxico para las plantas; el ion Al3+ es más soluble a pH bajo; por encima de pH 5,0, hay poco Al en forma soluble en la mayoría de los suelos (Hansson, Olsson, Olsson, Johansson, & Kleja, 2011; Kopittke, Menzies, Wang, & Blamey, 2016). El aluminio no es un nutriente vegetal, y como tal, no es absorbido activamente por las plantas, sino que entra a las raíces de las plantas pasivamente a través de la ósmosis. El aluminio inhibe el crecimiento de la raíz; las raíces laterales y las puntas se engrosan y las raíces carecen de ramificaciones finas; las puntas de las raíces pueden ponerse marrones. En la raíz, el efecto inicial de Al3+ es la inhibición de la expansión de las células de la rizodermis, lo que lleva a su ruptura; a partir de entonces se sabe que interfiere con muchos procesos fisiológicos que incluyen la captación y el transporte de calcio y otros nutrientes esenciales, la división celular, la formación de la pared celular y la actividad enzimática (Gupta, Gaurav, & Kumar, 2013; Kopittke et al., 2016; Rout, Samantaray, & Das, 2001).
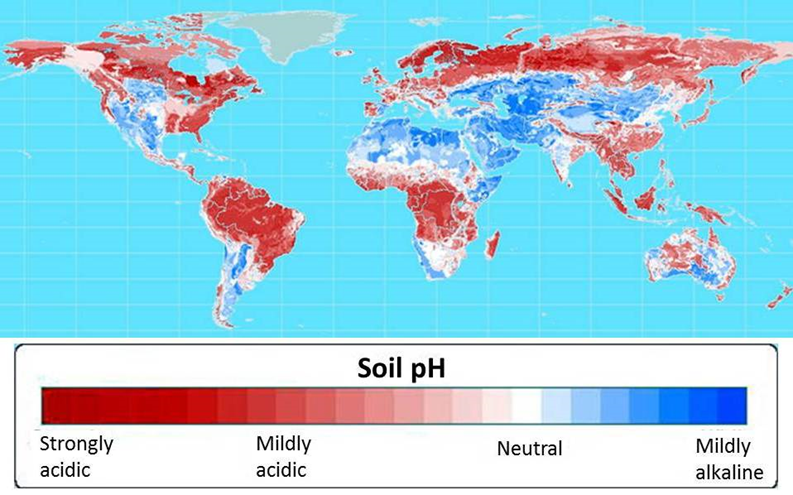
Figura 11‑1. Acidez de los suelos del mundo. Los desiertos tropicales y templados tienden a ubicarse en suelos medianamente alcalinos.
El estrés por iones de hidrógeno (ion H+) también puede limitar el crecimiento de las plantas. La bomba de protones, H+-ATPasa, del plasmalema de las células de la raíz trabaja para mantener el pH casi neutro de su citoplasma. Una alta actividad de protones (pH dentro del rango de 3,0-4,0 para la mayoría de las especies de plantas) en el medio de crecimiento externo supera la capacidad de la célula para mantener el pH citoplásmico y el crecimiento se detiene (Shavrukov & Hirai, 2015).
Disponibilidad de nutrientes en relación al pH
El pH del suelo afecta la disponibilidad de algunos nutrientes de las plantas. Como se discutió anteriormente, la toxicidad del aluminio tiene efectos directos sobre el crecimiento de las plantas; sin embargo, al limitar el crecimiento de la raíz, también reduce la disponibilidad de nutrientes de las plantas. Debido a que las raíces están dañadas, la absorción de nutrientes se reduce, y deficiencias de los macronutrientes (nitrógeno, fósforo, potasio, calcio y magnesio) se encuentran con frecuencia en suelos muy ácidos a ultra ácidos (pH <5.0) (Shavrukov & Hirai, 2015). La disponibilidad de molibdeno aumenta a un pH más alto; esto se debe a que el ion molibdato es absorbido con mayor fuerza por las partículas de arcilla a un pH más bajo (Huang, Li, & Sumner, 2011).
En suelos con un alto contenido de minerales que contienen manganeso, la toxicidad de Mn puede convertirse en un problema a pH 5,6 y menor. El manganeso, como el aluminio, se vuelve cada vez más soluble a medida que desciende el pH, y los síntomas de toxicidad de Mn se pueden ver a niveles de pH por debajo de 5,6. El manganeso es un nutriente vegetal esencial, por lo que las plantas transportan Mn a las hojas. Los síntomas clásicos de la toxicidad de Mn son arrugas o ahuecamiento de las hojas.
El zinc, el hierro, el cobre y el manganeso muestran una menor disponibilidad a un pH más alto (Huang et al., 2011). El efecto del pH sobre la disponibilidad de fósforo varía considerablemente, dependiendo de las condiciones del suelo y del cultivo en cuestión. La opinión predominante en los años 1940 y 1950 fue que la disponibilidad de P se maximiza cerca de la neutralidad (pH del suelo 6.5-7.5), y disminuye a un pH más alto y más bajo (Sumner & Farina, 1986; Truog, 1947). Sin embargo, las interacciones de fósforo con el pH en el rango de moderadamente a levemente ácido (pH 5.5-6.5) son mucho más complejas de lo que sugiere este punto de vista. Las pruebas de laboratorio, los ensayos en invernadero y los ensayos de campo han indicado que los aumentos en el pH dentro de este rango pueden aumentar, disminuir o no tener ningún efecto sobre la disponibilidad de P para las plantas (Haynes, 1982; Truog, 1947).



No hay comentarios:
Publicar un comentario