| Ciencias de Joseleg | Química | Química del equilibrio | Teoría ácido base | (Ejercicios) (Generalidades) (Teoría de Arrhenius) (Teoría de Brønsted-Lowry) (Constante de disociación ácida Ka) (Introducción a la teoría de Lewis) (Producto iónico del agua Kw) (El pH) (Reacciones ácido-base) (Indicadores de acidez) (Efecto de la acidez en el suelo) (Referencias bibliográficas)
En secciones anteriores mencionamos que el agua y su
constante de acidez o disociación son el ombligo del mundo de los ácidos y las
bases, pero antes debemos entender que, evidentemente el agua se ioniza, aunque
muy débilmente, por ende, su constante de acidez es baja, pero medible.
La auto-ionización del agua
Una visión completa de la auto-ionización del agua sería la
siguiente.
En una enorme colección de moléculas de agua, algunas pocas,
que llamaremos las “raritas” deciden reaccionar en parejas, una molécula de
agua funciona como un ácido y libera un protón, mientras que la otra funciona
como base y lo captura. Sin embargo, en la notación más común de esta
ionización ignoramos al agua que se comporta como base, y la ecuación química
pasa a expresarse como:
La neutralización y el agua pura
La auto-disociación del agua es importante debido a su
asociación con las reacciones de neutralización ácido-base. Desde la edad media
los alquimistas y luego los químicos emplearon colorantes para ver que
sustancia era ácido y base, también su potencia relativa y lo que pasaba al
neutralizar sus propiedades. De eso un patrón surgió, cuando los +ácidos se
neutralizan con las bases, la solución resultante tenia las propiedades
ácido-base del agua, de allí que el agua pura sea sinónimo de neutralidad.
La concentración de protones
De lo anterior se desprende la posibilidad de calcular la
cantidad relativa de protones (portadores de la acidez) mediante el
conocimiento de la constante de disociación del agua pura, y dicha
concentración en agua pura indicará la acidez del estado neutral, así como a
través de la comparación con esta parca de neutralidad indicar la acidez o
basicidad de una sustancia de forma numérica.
Modelo matemático
Iniciaremos estableciendo la constante de disociación ácida
del agua, que al ser una disociación agua propia del agua recibe el símbolo
especial de ( Kw
) y un nombre especial, producto iónico del agua:
DEMOSTRACIÓN: Obtener
el producto iónico del agua en términos de la constante de disociación ácida
del agua.
✔
Ejemplo: Si la concentración de iones protio medida
en agua ultra pura a 25 °C y 1 atm es de 10-7 M, (a) calcular el valor de la
concentración de iones hidróxido y (b) el valor de la constante de producto
ionico del agua.
(w por water que es la
palabra en ingles que significa agua).
Este valor es solo cierto bajo las condiciones termoquímicas estándar,
es decir 1 atm de presión y 25°C. Con la constante podemos calcular la
concentración de cada uno de los iones en la solución.
👉
La concentración molar de iones protio [H+] en neutralidad es igual a 10-7,
👉
una solución será ácida si la
concentración molar de iones protio [H+] es
mayor que 10-7,
👉
una solución será básica si la
concentración molar de iones protio [H+] es
menor que 10-7.
Como el término que más nos importa es la potencia, se
emplea una variable logarítmica inversa para hacer estas estimaciones más
fácilmente llamado pH también llamado potencial de hidrógeno.
Mezclando un ácido y agua
Si tenemos una mezcla de ácidos, la cantidad se iones protio
totales deben ser iguales a la suma de aportes del ácido y del agua, pero en
términos de sus cantidades de sustancia.
Sin embargo, los ácidos normalmente aportan varios ordenes
de magnitud más protones que la propia agua, y, por ende, normalmente ignoramos
el aporte del agua a la acidez general de un líquido acuoso.
La aproximación anterior es solo válida si el aporte de un
ácido supera como mínimo 10 veces los moles que aportaría el agua. Adicionalmente,
si tenemos un ácido mezclado en agua, su constante
de disociación ácida Ka podrá igualarse al producto iónico del agua Kw
pues estarán involucrados los iones de hidrógeno e hidróxido junto con el ácido
conjugado.
Química de Chang 10
✔ Ejemplo 15.2. La concentración de iones OH- en
cierta solución de limpieza de amoníaco doméstico es de 0.0025 M. Calcula la
concentración de iones H+.
✔ Práctica 15.2. Calcular la concentración de iones OH- en una disolución de HCl cuya concentración de iones de hidrógeno es 1.3 M.

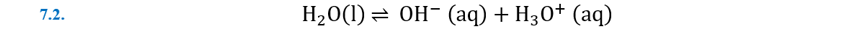






No hay comentarios:
Publicar un comentario