| Ciencias de Joseleg
| Química | Química del equillibrio | Cinética
química | (Ejercicios) (Introducción)
(Generalidades)
(Factores
que afectan la velocidad de reacción) (Historia)
(Velocidad
de reacción) (Velocidades
de aparición y desaparición) (Relación
entre velocidades de aparición, desaparición y reacción) (Ley
de velocidad de reacción) (Reacciones
de primer orden) (Reacciones
de segundo orden) (Reacciones
de cero orden) (Vida
media) (Energía
de activación) (Mecanismo
de reacción) (Catalizadores)
(Referencias)
Un catalizador es una sustancia que cambia la velocidad de una reacción química sin sufrir un cambio químico permanente. La mayoría de las reacciones en el cuerpo, la atmósfera y los océanos ocurren con la ayuda de catalizadores. Gran parte de la investigación química industrial es dedicada a la búsqueda de catalizadores más efectivos para reacciones de importancia comercial. También se dedican grandes esfuerzos de investigación a encontrar medios para inhibir o eliminar ciertos catalizadores que promueven reacciones indeseables, como las que corroen metales, envejecen nuestros cuerpos y causan caries.
Catálisis homogénea
Un catalizador que está presente en la misma fase que los reactivos en una
mezcla de reacción se llama catalizador homogéneo. Los ejemplos abundan tanto
en solución como en fase gaseosa. Considere, por ejemplo, la descomposición de
peróxido de hidrógeno acuoso, en agua y oxígeno: 2 H2O2(aq)→2H2O(l)+O2(g).
En ausencia de un catalizador, esta reacción ocurre de forma extremadamente
lenta. Sin embargo, muchas sustancias son capaces de catalizar la reacción,
incluido el ion bromuro, que reacciona con el peróxido de hidrógeno en solución
ácida, formando bromo acuoso y agua: H2O2(aq)+2Br-(aq)+2H+(aq)→2H2O(l)+Br2(aq).
Figura 15‑1. Catálisis homogénea. Efecto del catalizador sobre la velocidad de descomposición del peróxido de hidrógeno en agua y oxígeno gaseoso.
Si esta fuera la reacción completa, el ion bromuro no sería un catalizador porque experimenta un cambio químico durante la reacción. Sin embargo, el peróxido de hidrógeno también reacciona con el Br—(aq): H2O2(aq)+Br2(aq)→2Br-(aq)+2H+(aq)+O2(g)
Cuando el H2O2 se ha descompuesto por completo, nos
queda una solución incolora de Br— (aq), lo que significa que este
ion es de hecho un catalizador de la reacción porque acelera la reacción sin
sufrir ningún cambio neto. En contraste, Br2 (aq) es un intermedio
porque primero se forma y luego se consume. Ni el catalizador ni el intermedio
aparecen en la ecuación para la reacción global. Tenga en cuenta, sin embargo,
que el catalizador está allí al comienzo de la reacción, mientras que el
intermedio se forma durante el curso de la reacción.
¿Cómo funciona un catalizador? Si pensamos en la forma general de las leyes
de velocidad de reacción:
Debemos concluir que el catalizador debe afectar el valor numérico de
Donde
Figura 15‑2. Perfiles de energía para la
descomposición no catalizada y catalizada por bromuro de H2O2.
Un catalizador
puede reducir la energía de activación para una reacción al proporcionar un
mecanismo diferente para la reacción. En la descomposición del
peróxido de hidrógeno, por ejemplo, tienen lugar dos reacciones sucesivas de
Catálisis heterogénea
Un catalizador heterogéneo es uno que existe en una fase diferente de la
fase de las moléculas reactivas, generalmente como un sólido en contacto con
reactivos gaseosos o reactivos en una solución líquida. Muchas reacciones de
importancia industrial son catalizadas por las superficies de los sólidos. Por
ejemplo, el petróleo crudo se transforma en moléculas de hidrocarburos más
pequeñas mediante el uso de los llamados catalizadores de "craqueo".
Los catalizadores heterogéneos a menudo están compuestos de metales u óxidos
metálicos.
El paso inicial en la catálisis heterogénea suele ser la adsorción de reactivos. La adsorción se refiere a la unión de moléculas a una superficie, mientras que la absorción se refiere a la absorción de moléculas en el interior de una sustancia. La adsorción ocurre porque los átomos o iones en la superficie de un sólido son extremadamente reactivos. Debido a que la reacción catalizada ocurre en la superficie, a menudo se usan métodos especiales para preparar catalizadores para que tengan áreas de superficie muy grandes. A diferencia de sus contrapartes en el interior de la sustancia, los átomos e iones superficiales tienen una capacidad de unión no utilizada que puede usarse para unir moléculas desde la fase gaseosa o de solución a la superficie del sólido.
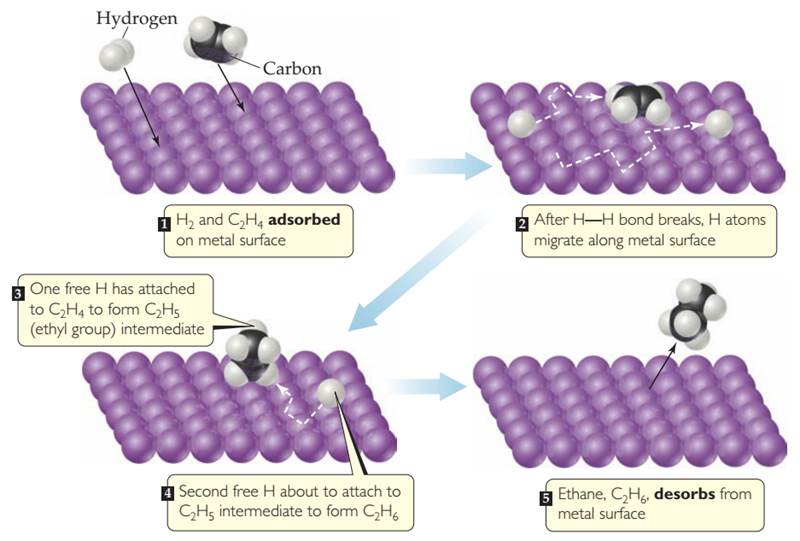
Figura 15‑3. Catálisis heterogénea. Mecanismo de reacción de
etileno con hidrógeno en una superficie catalítica.
La reacción del gas hidrógeno con el gas etileno para formar gas etano
proporciona un ejemplo de catálisis heterogénea: C2H4(g)+H2(g)→C2H6(g)
con un ΔHº=-137 kJ/mol. Aunque esta reacción es exotérmica, ocurre muy
lentamente en ausencia de un catalizador. Sin embargo, en presencia de un metal
finamente pulverizado, como el níquel, el paladio o el platino, la reacción se
produce fácilmente a temperatura ambiente a través del mecanismo diagramado en
la Figura 15‑3. Tanto el etileno
como el hidrógeno se adsorben en la superficie del metal. Tras la adsorción, el
enlace H-H del H2 se rompe, dejando inicialmente dos átomos de H
unidos a la superficie del metal pero relativamente libres para moverse. Cuando
un hidrógeno encuentra una molécula de etileno adsorbida, puede formar un
enlace
Enzimas
El cuerpo humano se caracteriza por un sistema extremadamente complejo de reacciones químicas interrelacionadas, todo lo cual debe ocurrir a ritmos cuidadosamente controlados para mantener la vida. Una gran cantidad de catalizadores biológicos maravillosamente eficientes conocidos como enzimas son necesarios para que muchas de estas reacciones ocurran a velocidades adecuadas. La mayoría de las enzimas son moléculas de proteínas grandes con pesos moleculares que varían de aproximadamente 10 000 a aproximadamente 1 millón de u. Son muy selectivos en las reacciones que catalizan (aunque pueden catalizar varias reacciones semejantes con sustratos parecidos), y algunos son absolutamente específicos, que operan para una sola sustancia en una sola reacción. La descomposición del peróxido de hidrógeno, por ejemplo, es un proceso biológico importante. Debido a que el peróxido de hidrógeno se oxida fuertemente, puede ser fisiológicamente dañino. Por esta razón, la sangre y el hígado de los mamíferos contienen una enzima, la catalasa, que cataliza la descomposición del peróxido de hidrógeno en agua y oxígeno.
Figura 15‑4. Las enzimas aceleran las reacciones. El hígado
macerado libera muchas enzimas, entre ellas la catalasa, que agregada al agua
oxigenada, libera oxígeno.
La Figura 15‑4 muestra la aceleración dramática de esta reacción química por la catalasa en el hígado de res. La reacción que cataliza cualquier enzima dada tiene lugar en una ubicación específica en la enzima llamada sitio activo. Las sustancias que reaccionan en este sitio se llaman sustratos. El modelo de cerradura y llave proporciona una explicación simple de la especificidad de una enzima.
Figura 15‑5. Modelo de cerradura y llave para la acción enzimática.
La combinación de enzima y sustrato se llama complejo enzima-sustrato.
Aunque la Figura 15‑5 muestra que tanto
el sitio activo como su sustrato tienen una forma fija, el sitio activo a
menudo es bastante flexible y, por lo tanto, puede cambiar de forma a medida
que se une al sustrato. La unión entre el sustrato y el sitio activo implica
atracciones dipolo-dipolo, enlaces de hidrógeno y fuerzas de dispersión. A
medida que las moléculas de sustrato ingresan al sitio activo, se activan de
alguna manera para que puedan reaccionar rápidamente. Este proceso de
activación puede ocurrir, por ejemplo, por el retiro o la donación de densidad
electrónica de un enlace particular o grupo de átomos en el sitio activo de la
enzima. Además, el sustrato puede distorsionarse en el proceso de adaptación al
sitio activo y hacerse más reactivo. Una vez que se produce la reacción, los
productos salen del sitio activo, permitiendo que entre otra molécula de
sustrato.
El sustrato se muestra como que encaja perfectamente en el sitio activo, al igual que una llave encaja en una cerradura. La lisozima es una enzima que es importante para el funcionamiento de nuestro sistema inmunitario porque acelera las reacciones que dañan (o "lisan") las paredes celulares bacterianas. La Figura 15‑6 muestra un modelo de la enzima lisozima sin y con una molécula de sustrato unida.
Figura 15‑6. La lisozima fue una de las primeras enzimas para las cuales se describió una relación estructura-función. Este modelo muestra cómo el sustrato (amarillo) "encaja" en el sitio activo de la enzima.
Las enzimas son enormemente más eficientes que los catalizadores no
bioquímicos. El número de eventos de reacción catalizados individuales que
ocurren en un sitio activo particular, llamado número de rotación, generalmente
está en el rango de 103 a 107 por segundo. Tales números
de rotación grandes corresponden a energías de activación muy bajas. En
comparación con un catalizador químico simple, las enzimas pueden aumentar la
velocidad constante para una reacción dada en un millón de veces o más.










No hay comentarios:
Publicar un comentario