👉 𝑬𝒏𝒖𝒏𝒄𝒊𝒂𝒅𝒐: Se midió la velocidad de desaparición de HCl para la siguiente reacción: CH3OH + HCl → CH3Cl + H2O. Se recogieron los siguientes datos: a 0.0 min 1.85 molar, a 54.0 minutos 1.58 molar. a 107.0 minutos 1.36 molar, a 215.0 minutos 1.02 molar, a 430.0 minutos 0.580 molar. (d) Grafique [HCl] contra el tiempo y determine las velocidades instantáneas en M/min y M/s en t = 75.0 min y t = 250 min.
|| Enlace a YouTube || Mas
ejercicios resueltos de cinética química || Mas
ejercicios de otros capítulos || Curso
de cinética química || ¡Si te
gustó, suscríbete! ||
👉 𝑫𝒆𝒎𝒐𝒔𝒕𝒓𝒂𝒄𝒊𝒐𝒏𝒆𝒔 𝒚/𝒐 𝒄𝒐𝒏𝒄𝒆𝒑𝒕𝒐𝒔 𝒕𝒆ó𝒓𝒊𝒄𝒐𝒔:
👉 𝑺𝒐𝒍𝒖𝒄𝒊ó𝒏:
Empleando
la calculadora de derivación:
En consecuencia a 75 minutos la rapidez de desaparición instantánea es de -6.13 x 10-5 M/s o -3.68 x 10-3 M/min; y a 250 minutos la rapidez de desaparición instantánea es de -4.03 x 10-5 M/s o -2.42 x 10-3 M/min;
👉 𝑶𝒕𝒓𝒐𝒔 𝒆𝒏𝒖𝒏𝒄𝒊𝒂𝒅𝒐𝒔: Graficar la [HCl] contra tiempo y calcular la
velocidad de desaparición instantánea de HCl, Graficar la [HCl] contra tiempo y
calcular la rapidez de desaparición instantánea de HCl, Graficar la [HCl]
contra tiempo y calcular la tasa de desaparición instantánea de HCl,
👉 𝑻𝒆𝒎𝒂𝒔: química, química general, cinetoquímica, cinetoquimica, cinética
química, joseleg, velocidad de reacción, rapidez de reacción, tasa de reacción,
avance de reacción, velocidad de aparición de un producto, rapidez de aparición
de un producto, rapidez de aparición de un producto, velocidad de desaparición
de un reactivo, rapidez de desaparición de un reactivo, tasa de desaparición de
un reactivo

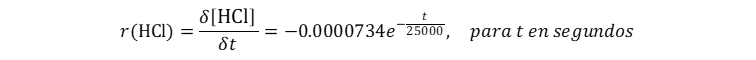


No hay comentarios:
Publicar un comentario