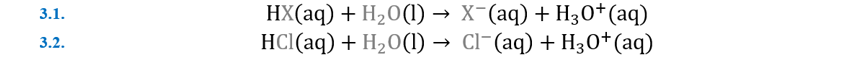| Ciencias de Joseleg | Química | Química del equilibrio | Teoría ácido base | (Ejercicios) (Generalidades) (Teoría de Arrhenius) (Teoría de Brønsted-Lowry) (Constante de disociación ácida Ka) (Introducción a la teoría de Lewis) (Producto iónico del agua Kw) (El pH) (Reacciones ácido-base) (Indicadores de acidez) (Efecto de la acidez en el suelo) (Referencias bibliográficas)
Actualmente los ácidos y bases se estudian en base a tres
teorías, basadas en los principales científicos que las propusieron, sin
embargo, las tres se fundamentan en el entendimiento de las reacciones de
ionización, y, por ende, se involucran los conceptos del equilibrio químico.
Ionización
Michael Faraday comenzó a trabajar en el problema de la
conductividad de ciertas soluciones hacia 1833 y propuso la existencia de
iones, sustancias cargadas que pudieran explicar las características eléctricas
de las soluciones conductoras. Sin embargo, esta hipótesis no fue muy del
agrado de gran parte de la comunidad científica, por el hecho de que los iones
eran y siguen siendo especies químicas hipotéticas, un modelo mental que ayuda
a explicar fenómenos, pero que en términos prácticos no eran empíricamente
observables “y para ser francos sucedía algo muy parecido con el concepto de
átomo”. Sin embargo, el significado de los iones de Faraday se diferenciaría
del concepto actual en el sentido de que eran portadores de electricidad.
Arrhenius modifica el significado de ion, indicando que se
producen por la disociación de una especie química, en este sentido mientras
que los iones en Faraday tienen significado desde que exista una corriente
eléctrica “son portadores de la misma” en Arrhenius los iones existen con
independencia a la electricidad. La teoría tardó en aceptarse, pero se volvió
hegemónica hacia 1903.
Portadores de acidez y basicidad en la
teoría de Arrhenius
De forma resumida podemos proponer que los ácidos son sustancias que al disolverse
en agua incrementan la concentración de iones hidrónio H3O+(ac).
Mientras que una base es una sustancia que disuelta en agua incrementa la concentración de iones hidroxilo OH—(ac).
En muchos textos o ejercicios de lápiz y papel con
frecuencia el ion hidronio es reducido a un protón H+(ac), sin
embargo, en base a la teoría de Arrhenius y a las posteriores este protón no
será una especie química independiente, se encuentra unida mediante puente de
hidrógeno a una molécula de agua. Esta es en resumen la teoría de Arrhenius,
donde la identidad del ácido es asociada a los iones hidronio y la identidad de
base a los iones hidroxilo siempre en una solución acuosa.
Inconsistencias con la teoría ácido-basa de Arrhenius
Más allá de sus éxitos, el modelo de Arrhenius era limitado
e inconsistente con cierta evidencia experimental. Muchas reacciones acido-base
reaccionan independientemente al agua. Un caso especial bastante problemático
es la propiedad básica del amoniaco NH3. Cuando el amoniaco se
disuelve en agua este no sede protones, sino que los consume disminuyendo la
concentración de protones en agua. Las sustancias vegetales llamadas alcaloides
poseen muchos grumos semejantes al amonio, y se comportan de forma semejante,
aumentando la cantidad de hidróxidos, y por ende, generando una solución básica
o alcalina, de allí su nombre de alcaloides, porque alcalinizan. Dado que la
definición de Arrhenius no explicaba las propiedades alcalinas del amoníaco y
los alcaloides, pues no poseen grupos hidroxilos propios.
|
|
Más aun el amoniaco puede neutralizar a los ácidos en
ausencia de agua “en ausencia de grupos hidroxilo”, en presencia de solventes
diferentes del agua como el benceno o inclusive en fase gaseosa, y todas estas
reacciones no pueden predecirse en base a la definición ácido/base de
Arrhenius. Estas anomalías dieron poco a poco pie para el desarrollo de una
nieva teoría ácido base.