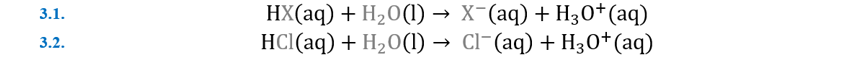| Ciencias de Joseleg
| Química | Química del equilibrio | Teoría
ácido base | (Ejercicios)
(Generalidades)
(Teoría
de Arrhenius) (Teoría
de Brønsted-Lowry) (Constante
de disociación ácida Ka) (Introducción
a la teoría de Lewis) (Producto
iónico del agua Kw) (El
pH) (Reacciones
ácido-base) (Indicadores
de acidez) (Efecto
de la acidez en el suelo) (Referencias
bibliográficas)
Algunos de los procesos más importantes en los sistemas
químicos y biológicos son las reacciones ácido-base en soluciones acuosas. Sin
embargo, tenemos un problema, aunque intuitivamente sabemos que es un ácido, no
pasa lo mismo con una base, y las definiciones que empleamos en el contexto
químico dependerán de un marco de referencia teórico.
Las tres teorías principales que se desarrollaron
históricamente se fundamentan en reacciones de disociación iónica, siendo
estas, la teoría de Arrhenius, la teoría de Brønsted-Lowry y la teoría de
Lewis. Sin embargo, antes de discutir las teorías ácido base, hablaremos algo
de la historia del estudio de los ácidos y bases.
Figura 2‑1. Svante
Arrhenius (1859-1927) Fue un científico (originalmente físico y más
tarde químico) y profesor sueco galardonado con el Premio Nobel de Química de
1903 por su contribución al desarrollo de la química con sus experimentos en el
campo de la disociación electrolítica.
Durante la época de los antiguos griegos, las propiedades de
los ácidos y las bases solo se entendían vagamente. Durante sus intentos de
categorizar sustancias y tratar de aportar equilibrio, armonía y perfección al
universo, utilizaron una variedad de pruebas para distinguir los compuestos.
Uno de ellos era el gusto, y dividían las sustancias según si eran agrias,
amargas, saladas o dulces. A medida que la influencia griega disminuyó y su
conocimiento pasó a los romanos, comenzaron a referirse a las sustancias
agrias, como el vinagre o el jugo de limón, como ácidos. Las palabras
"ácido" y "acético" derivan de la palabra latina
"sabor ácido", acere. Las bases, por el contrario, no fueron tan bien
estudiadas, aunque se las reconoció como sustancias
que neutralizarían los ácidos, algo que encajaba bien con el deseo de los
antiguos de encontrar equilibrio y armonía en todo (Brock, 2016; Larrañaga,
Lewis, & Lewis, 2016; Levere, 2001).
A medida que la ciencia avanzaba a través de la Edad de Oro
Islámica y el Renacimiento, los alquimistas comenzaron a entender más sobre los
ácidos, descubriendo que las soluciones más fuertes podían acelerar la
corrosión del metal y disolver ciertas rocas. Los alquimistas medievales e
islámicos tenían una variedad de ácidos y bases para elegir: Soda (carbonato de
sodio); Potasa (carbonato de potasio); Amoníaco; Ácido clorhídrico; Ácido
sulfúrico; Ácido acético; Ácido nítrico; Aqua regia; una mezcla de ácido
nítrico y ácido clorhídrico que incluso podría disolver el oro (Eliade & Ledesma,
1974).
Las bases también se denominan álcalis, una palabra derivada de la palabra
árabe para "tostar", aunque no está claro por qué más tarde se
llamarían bases. Ambas palabras son perfectamente aceptables y a menudo se
intercambian (Brock, 2016; Larrañaga,
Lewis, & Lewis, 2016; Levere, 2001)
Figura 2‑2. Roccella tinctoria, nombre vulgar
Urzela.
Aproximadamente en 1300, un erudito español, Arnaldus de
Villa Nova, comenzó a usar tornasol para estudiar ácidos y bases. Este
compuesto, extraído de un liquen, se había usado como tinte desde al menos los
tiempos de los vikingos, pero fue el primer erudito conocido en usarlo como una
prueba de acidez (Coleman, 2008). Esta idea fue ampliada por
Robert Boyle (1627-1691), quien descubrió que ciertas sustancias derivadas de
plantas cambiaban de color en presencia de ácidos o bases. Un ejemplo fue el
jarabe de violetas, que es azul en un entorno de pH neutro, pero se vuelve
verde cuando se expone a las bases, y rojo cuando se mezcla con ácido. Estos
compuestos de prueba abrieron un campo de posibilidades, y los químicos
pudieron determinar qué proporción de ácidos y bases se neutralizarían entre
sí, permitiéndoles comparar crudamente las fortalezas relativas de estas
sustancias (Bishop, 2013; Eamon,
1980).
Estas primeras teorías ácido base se consideran obsoletas,
pero recalcan la importancia de estas sustancias en el marco de referencia de
los primeros químicos que intentaban desligarse de la metafísica y
espiritualidad propia de la alquimia.
Durante la mayor parte del siglo XVIII, cuando prevaleció la
teoría termodinámica del flogisto, la idea de que el calor era un elemento
separado contenido en materiales combustibles. Georg Ernst Stahl (1659-1734)
propuso que los ácidos se derivaban todos del azufre y que la fuerza era
dictada por la cantidad de flogisto; esta visión se rompería a fines de siglo.
No fue sino hasta la época de Antoine Lavoisier (1743-1794),
un brillante químico francés que intentó clasificar elementos y comprender la naturaleza
del calor, que tuvo lugar un estudio más sistemático de ácidos y bases. En este
momento, los químicos comenzaron a definir
las bases como sustancias que podrían neutralizar los ácidos para formar agua y
una sal. En 1776, influenciado por estudios sobre las propiedades de los
gases, Lavoisier intentó aislar el compuesto en ácidos responsables de sus propiedades
únicas. Incorrectamente, propuso que una sustancia llamada oxígeno era
responsable, pero sus observaciones llevaron a nuevos estudios. El científico
británico Humphrey Davy (1778-1829), más conocido por sus estudios en gases,
puso a prueba las teorías de Lavoisier y descubrió que el oxígeno no era el
elemento responsable de las propiedades de los ácidos. Muchos ácidos no
contienen oxígeno, por lo que propuso que algo más debe ser responsable.
Durante la Era de la Ilustración, los estudiosos de muchos países diferentes
contribuyeron a la explosión en el esfuerzo científico, y el estudio de los
ácidos no fue diferente.
En Alemania, Justus Frieherr von Liebig (1803-1873), otro
químico innovador, en su lugar aisló al hidrógeno como el elemento responsable,
razonando que era el único elemento común a todos los ácidos. El químico sueco,
Svante Arrhenius (1859-1927), fue el próximo químico en estudiar los ácidos y
las bases, y propuso que los ácidos y las bases obtuvieran sus propiedades
debido a la acción de los iones en la solución. A pesar de ser ignorado de sus
compañeros, fue galardonado con el Premio Nobel en 1903, en un ejemplo perfecto
de cómo los científicos marginales pueden jugar un gran papel en los cambios de
paradigma. Uno de los edificios de la Universidad de Estocolmo lleva el nombre
de este gran químico, un homenaje apropiado. Arrhenius afirmó que los ácidos
son simplemente sustancias que agregan cationes de hidrógeno, H+ al
agua. Por ejemplo, el ácido clorhídrico, HCl, agrega iones H+ y Cl-
al agua. Por el contrario, los álcalis agregan iones de hidroxilo, OH-.
Por ejemplo, el hidróxido de sodio, agrega Na+ y OH- al
agua. La razón por la que los ácidos y las bases se anulan es porque los iones
H+ y OH- reaccionan para formar agua, dejando atrás
sales: Esta definición era bastante sólida y la investigación sobre estas
sustancias continuó.

Figura 2‑3. Michael Faraday (1791-1867). Fue un
físico y químico británico que estudió el electromagnetismo y la
electroquímica. Sus principales descubrimientos incluyen la inducción
electromagnética, el diamagnetismo y la electrólisis.